Tampilkan postingan dengan label Fisika. Tampilkan semua postingan
Tampilkan postingan dengan label Fisika. Tampilkan semua postingan
Senin, 30 April 2012
Interaksi Fundamental Alam Semesta
1. Gaya Nuklir Kuat atau Gaya Inti Kuat (strong nuclear force)
Gaya nuklir kuat atau gaya inti kuat adalah gaya yang menjaga inti tetap utuh, yang merupakan gaya yang paling dahsyat menurut hukum-hukum fisika.
Gaya ini menjaga proton dan neutron dalam inti atom tetap di tempatnya. Gaya ini sangat kuat sehingga nyaris menyebabkan proton dan neutron dalam inti atom saling berikatan.
Jarak gaya nuklir kuat sangat pendek, bahkan tidak dapat dirasakan pada jarak lebih dari garis tengah inti atom sehingga sepanjang itulah ukuran garis tengan inti atom.
Kekuatan ikatan tersebut disesuaikan dengan sangat teliti. Kemampuan gaya nuklir kuat lebih kuat dari pada gaya elektromagnetik (sekitar seratus kali) dan gaya gravitasi. Intensitas gaya ini pun telah diatur secara spesifik oleh Rabbul ‘Izzati agar proton dan neutron tetap berada pada jarak tertentu. Dengan kata lain akan terjadi tabrakan ataupun saling bertolakan antar proton yang bermuatan positif dan neutron yang tidak bermuatan jika besar gaya tersebut tidak sesuai dengan yang dibutuhkan untuk membentuk inti atom. Dan tentunya alam raya ini pun tidak akan terbentuk sempurna seperti sekarang ini jika porsi yang diberikan gaya nuklir kuat tidak sesuai untuk membentuk inti atom.
2. Gaya Nuklir Lemah atau Gaya Inti Lemah (weak nuclear force)
Gaya nuklir lemah atau sering disebut juga interaksi inti lemah adalah gaya yang bertanggung jawab atas keseimbangan antara proton dan neutron dalam inti atom ketika terjadi proses peluruhan radioaktif saat inti atom yang tidak stabil membelah (fisi) menjadi dua atau lebih sehingga tidak tiba-tiba terurai atau memancarkan radisi yang berbahaya.
Dinamakan interaksi lemah karena kemampuan gaya ini lebih lemah dari pada gaya nuklir kuat dan keelektromagnetan serta lebih kuat dari pada gaya gravitasi sekitar 1025 kali.
Interaksi inti lemah juga menjadi pendorong proses peluruhan beta. Yaitu proses yang terjadi apabila sebuah neutron terasing secara tiba-tiba (menurut sains manusia dan secara sistematis serta sempurna menurut Maha Luasanya Ilmu Allah Rabbul ‘Izzati) memancarkan sebuah elektron yang dahulu dikenal sebagai sinar beta bersama antineutrino elektron yang kemudian beralih bentuk menjadi proton. Walaupun banyak elektron yang terjaga karena antineutrino elektron yang menyeimbangkan neraca. Hal ini boleh dan bisa terjadi dalam aturan kuantum.
3. Gaya Elektromagnetik (electromagnetic force)
Gaya elektromagnetik adalah gaya yang diakibatkan oleh medan elektromagnetik terhadap partikel-partikel yang bermuatan listrik. Gaya inilah yang Gaya inilah yang membuat partikel-partikel yang bermuatan listrik berlawanan saling tarik-menarik dan partikel-partikel bermuatan sama akan saling tolak-tolak menolak. Sehingga menjaga elektron-elektron dan proton-proton tetap bersama dalam sebuah atom serta menjaga atom-atom tetap bersama dalam sebuah molekul.
Perubahan kekuatan sekecil apa pun pada gaya ini dapat menyebabkan atom tidak terbentuk dikarenakan elektron-elektron terlepas jauh dari inti atom atau sebaliknya. Dan konsekwensinya alam raya ini pun tidak akan terbentuk.
4. Gaya Gravitasi (gravity)
Gravitasi adalah gaya tarik-menarik yang terjadi antara semua partikel yang mempunyai massa dialam semesta. Fisika modern mendeskripsikan gravitasi menggunakan Teori Relativitas Umum dari Einstein (Teori yang melihat gravitasi bukan sebagai gaya, tetapi lebih sebagai manifestasi dari kelengkungan ruang dan waktu), namun hukum gravitasi universal Newton yang lebih sederhana merupakan paparan yang cukup akurat dalam kebanyakan kasus.
Gaya inilah yang menyebabkan galaksi-galaksi, planet-planet dan bintang-bintang yang berada di alam semesta ini tetap pada orbitnya masing-masing. Perubahan sekecil apapun pada gaya ini dapat menyebabkan benda-benda langit menjadi saling bertabrakan atau keluar dari orbitnya masing-masing.
sumber : Wikipedia
Selasa, 13 Maret 2012
Fisika Nuklir
Mungkin kita pernah menyaksikan film-film perang yang menggambarkan
suatu ledakan bom nuklir. Tetapi sesungguhnya dari 195 negara di dunia
ini tercatat hanya 20 negara yang memiliki senjata nuklir. Delapan
diantaranya memiliki jumlah yang terbanyak, yaitu: (1) Amerika Serikat;
(2) Rusia; (3) Inggris; (4) Perancis; (5)China; (6) India; (7) Pakistan;
(8) Israel. Delapan negara inilah yang memiliki teknologi terdepan
dalam mengembangkan senjata nuklir. Ketika prestise, simbol, dan rasa
keamanan menjadi hal penting, masuk akal kalau di luar delapan negara
tadi masih ada banyak negara yang memendam hasrat untuk memiliki senjata
yang berkekuatan dahsyat itu.
Tanggal 6 Agustus 63 tahun yang lalu, kota Hiroshima di Jepang menjadi korban ‘little boy’ yang dijatuhkan melalui pesawat B-29 Superfortress Enola Gay yang dikendalikan oleh Kolonel Paul Tibetts. 3 hari kemudian tipe yang lebih kuat, ‘fat man’ dijatuhkan di kota Nagasaki.
Inilah peristiwa pertama bom nuklir digunakan dalam medan perang. Sebenarnya apa yang terjadi ketika bom nuklir itu dijatuhkan? Bagaimana mekanisme yang terjadi ketika bom nuklir itu digunakan? Sesungguhnya, manusia telah mengalami suatu lompatan dalam ilmu sains dengan adanya teknologi pemusnah massal, bom nuklir.
» TINJAUAN FISIKA pada BOM NUKLIR
Dalam bom nuklir terdapat dua jenis interaksi gaya yaitu, interaksi kuat dan interaksi lemah, yang menyebabkan nukleus dalam atom tetap terikat satu sama lain, terutama untuk atom-atom yang memiliki ikatan nuklida yang tak stabil. Dalam hal ini, terdapat dua cara bagaimana energi nuklir dapat dihasilkan dari suatu atom:
» BOM ATOM DAN JUMLAH ENERGINYA
Bom atom (atau bom fisi) menggunakan suatu atom berat seperti U-235 untuk menghasilkan ledakan nuklir. U-235 (Uranium dengan nomor massa 235) memiliki beberapa karakteristik tambahan yang menyebabkan atom ini dapat digunakan baik untuk keperluan pembangkit energi listrik atau penghasil bom atom. U-235 merupakan salah satu dari beberapa material yang dapat mengalami reaksi fisi terinduksi. Jadi, ketika sebuah neutron bebas menumbuk inti U-235, maka U-235 menjadi tidak stabil dan akan segera membelah menjadi inti-inti atom lain yang lebih kecil dan diikuti dengan dua atau tiga buah neutron baru (lihat gambar reaksi fisi). Atom-atom baru yang terbentuk akan mengemisikan radiasi sinar gamma untuk mencapai keadaan stabilnya. Setidaknya ada tiga hal yang membuat reaksi fisi terinduksi menjadi sangat penting dan menarik antara lain:
Ternyata energi yang dapat dihasilkan oleh bom atom sangat besar jumlahnya. Hal inilah yang membuat 8 negara diatas dianggap sebagai negara yang sangat rentan terhadap peperangan, karena mereka yakin akan teknologi senjata nuklir yang mereka kembangkan di negaranya masing-masing. Di Indonesia? Tampaknya belum terlihat gelagat menuju ke arah sana…
Tanggal 6 Agustus 63 tahun yang lalu, kota Hiroshima di Jepang menjadi korban ‘little boy’ yang dijatuhkan melalui pesawat B-29 Superfortress Enola Gay yang dikendalikan oleh Kolonel Paul Tibetts. 3 hari kemudian tipe yang lebih kuat, ‘fat man’ dijatuhkan di kota Nagasaki.
Inilah peristiwa pertama bom nuklir digunakan dalam medan perang. Sebenarnya apa yang terjadi ketika bom nuklir itu dijatuhkan? Bagaimana mekanisme yang terjadi ketika bom nuklir itu digunakan? Sesungguhnya, manusia telah mengalami suatu lompatan dalam ilmu sains dengan adanya teknologi pemusnah massal, bom nuklir.
» TINJAUAN FISIKA pada BOM NUKLIR
Dalam bom nuklir terdapat dua jenis interaksi gaya yaitu, interaksi kuat dan interaksi lemah, yang menyebabkan nukleus dalam atom tetap terikat satu sama lain, terutama untuk atom-atom yang memiliki ikatan nuklida yang tak stabil. Dalam hal ini, terdapat dua cara bagaimana energi nuklir dapat dihasilkan dari suatu atom:
- Fisi Nuklir, yaitu memisahkan nukleus dari suatu atom menjadi dua bagian yang lebih kecil dengan sebuah neutron. Biasanya metode ini menggunakan isotop-isotop uranium seperti U-235 atau U-233 atau dapat pula menggunakan Plutonium-239.
- Fusi Nuklir, yaitu menggabungkan 2 jenis atom-atom kecil seperti atom hidrogen atau isotopnya seperti deuterium atau tritium menjadi atom yang lebih besar (misal: Helium). Proses ini sama halnya dengan apa yang terjadi di matahari kita.
» BOM ATOM DAN JUMLAH ENERGINYA
Bom atom (atau bom fisi) menggunakan suatu atom berat seperti U-235 untuk menghasilkan ledakan nuklir. U-235 (Uranium dengan nomor massa 235) memiliki beberapa karakteristik tambahan yang menyebabkan atom ini dapat digunakan baik untuk keperluan pembangkit energi listrik atau penghasil bom atom. U-235 merupakan salah satu dari beberapa material yang dapat mengalami reaksi fisi terinduksi. Jadi, ketika sebuah neutron bebas menumbuk inti U-235, maka U-235 menjadi tidak stabil dan akan segera membelah menjadi inti-inti atom lain yang lebih kecil dan diikuti dengan dua atau tiga buah neutron baru (lihat gambar reaksi fisi). Atom-atom baru yang terbentuk akan mengemisikan radiasi sinar gamma untuk mencapai keadaan stabilnya. Setidaknya ada tiga hal yang membuat reaksi fisi terinduksi menjadi sangat penting dan menarik antara lain:
- Probabilitas atom U-235 untuk menangkap neutron bebas lebih besar daripada melewatkannya, sehingga atom ini sangat reaktif dengan keberadaan neutron bebas. Dalam ledakan bom atom lebih dari satu neutron dilepaskan pada tiap reaksi fisi yang terjadi. Oleh karena itu, hal ini dapat memicu terjadinya reaksi fisi lain disekitarnya. Reaksi ini yang kemudian terkenal dengan nama ‘reaksi berantai’. Keadaan yang demikian ini dinamakan keadaan superkritis (supercriticality).
- Proses penangkapan neutron dan pembelahan atom terjadi sangat cepat, biasanya dalam orde pikosekon (10-12 detik).
- Peristiwa ini menghasilkan energi yang sangat besar jumlahnya dan
disertai dengan panas yang luar biasa dan tidak lupa, radiasi sinar
gamma. Untuk menghitung secara kuantitatif jumlah energi yang dihasilkan
oleh reaksi fisi caranya sangat mudah.
Misalkan, terjadi reaksi fisi sebagai berikut:U-235 + n ? produk fisi 1 + produk fisi 2 + n + 200 MeVPada reaksi di atas, telah diketahui energi yang dihasilkan dalam sebuah reaksi fisi, nilai 200 MeV hanya sebuah perkiraan, perhitungan yang lebih baik dapat dilakukan dengan menjumlahkan nomor massa dari masing-masing produk fisi (misal: T), kemudian nomor massa U-235 dikurangi dengan T, sehingga 235 – T = S, dan S > 0, selanjutnya konversikan menjadi energi menggunakan persamaan E = mc2 dan diperoleh energi yang dihasilkan reaksi fisi tersebut. Tidak sulit bukan? (mudah dari Hongkong…) =))
Langkah selanjutnya ialah memperkirakan daya listrik yang dapat digunakan jika hanya sejumlah U-235 yang bereaksi (agar lebih mudah ambil 1 gram U-235 yang bereaksi). Dengan demikian,

Ternyata energi yang dapat dihasilkan oleh bom atom sangat besar jumlahnya. Hal inilah yang membuat 8 negara diatas dianggap sebagai negara yang sangat rentan terhadap peperangan, karena mereka yakin akan teknologi senjata nuklir yang mereka kembangkan di negaranya masing-masing. Di Indonesia? Tampaknya belum terlihat gelagat menuju ke arah sana…
Senin, 12 Maret 2012
Penentuan Panjang Gelombang
Panjang gelombang adalah sebuah jarak antara satuan berulang dari sebuah pola gelombang. Biasanya memiliki denotasi huruf Yunani lambda (λ).
Dalam sebuah gelombang sinus, panjang gelombang adalah jarak antara puncak:
Axis x mewakilkan panjang, dan I mewakilkan kuantitas yang bervariasi (misalnya tekanan udara untuk sebuah gelombang suara atau kekuatan listrik atau medan magnet untuk cahaya), pada suatu titik dalam fungsi waktu x.
Panjang gelombang λ memiliki hubungan inverse terhadap frekuensi f, jumlah puncak untuk melewati sebuah titik dalam sebuah waktu yang diberikan. Panjan gelombang sama dengan kecepatan jenis gelombang dibagi oleh frekuensi gelombang. Ketika berhadapan dengan radiasi elektromagnetik dalam ruang hampa, kecepatan ini adalah kecepatan cahaya c, untuku sinyal (gelombang) di udara, ini merupakan kecepatan suara di udara. Hubungannya adalah:
 di mana:
di mana:- λ = panjang gelombang dari sebuah gelombang suara atau gelombang elektromagnetik
- c = kecepatan cahaya dalam vakum = 299,792.458 km/dtk ~ 300,000 km/dtk = 300,000,000 m/dtk atau
- c = kecepatan suara dalam udara = 343 m/d pada 20 °C (68 °F)
- f = frekuensi gelombang
Pemanfaatan Gelombang Elektromagnetik
1. Apa itu gelombang elektromagnetik?
Gelomabang elektromagnetik adalah gelombang yang perambatannya tidak memerlukan medium.
Gelombang ini dapat merambat tidak hanya pada konduktor tetapi juga pada segala macam medium termasuk isolator atau ruang hampa.
Sifat-sifat gelombang elektromagnetik :
· dapat merambat diruang hampa
· merupakan gelombang transversal
· dapat mengalami polarisasi
· dapat mengalami pemantulan (refleksi)
· dapat mengalami pembiasan (refraksi)
· dapat mengalami interferensi
· dapat mengalami lenturan atau hamburan (difraksi)
· marambat dalam arah lurus
Gelombang
elektromagnetikterdiri dari bermacam-macam gelombang yang berbeda
frekuensi & panjang gelombangnya. Tetapi kecepatannya diruang hampa
adalah sama. (c= 3x108 m/s)
2. Manfaat Gelombang Elektromagnetik di bidang teknologi
Perlu
diketahui. Rentang/spektrum Gelombang Elektromagnetik (GEM). Terdiri
dari beberapa urutan, yakni sinar gamma, sinar X, ultra violet, cahaya
tampak, infra merah, gelombang mikro, gelombang TV dan gelombang radio, dst dalam urutan ini frekuensinya makin kecil, tapi panjang gelombangnya makin besar.
1. Sinar Gamma.
· frekuensinya : 1020 hz -sd- 1025 hz
· mempunyai daya daya tembus sangat besar
· Manfaat:
- industri untuk mengetahui struktur logam
- pertanian untuk membuat bibit unggul
- teknik nuklir untuk membuat radioisotope
- kedokteran untuk terapi dan diagnosis
- farmasi untuk sterilisasi
2. Sinar X.
· frekuensinya : 1016 hz -sd- 1020 hz
· daya tembus besar
· Manfaat:
- dipakai untuk mendeteksi organ organ dalam tubuh
- (misal : menentukan posisi tulang yang patah)
3. Ultra Violet.
· frekuensinya : 1015 hz -sd- 1016 hz
· sumber utamanya matahari
· Manfaat:
- diperlukan pada proses asimilasi tumbuhan
- membunuh beberapa jenis kuman penyakit kulit
- Digunakan untuk satelit
4. Cahaya Tampak.
· satu-satunya GEM yang dapat dilihat (teramati mata manusia)
· panjang gelombangnya : 430 nm -sd- 690 nm
· (rentang frekuensinya sempit)
· Manfaat: membuat kita dapat melihat
5. Infra Merah.
· frekuensinya : 1011 hz -sd- 1014 hz
· Manfaat:
- digunakan pada fotografi (pemotretan dari udara atau satelit)
untuk pemetaan permukaan bumi dan sumber-sumber alam
- dapat juga dipakai pada terapi fisik (physical therapy)
- Bisa digunakan untuk remote benda elektronik
6. Gelombang Radar atau gelombang mikro.
· untuk mendeteksi pesawat yang bergerak mendekati/menjauhi pangkalan udara.
· dapat juga dipakai pada sarana komunikasi.
· untuk radar
7. Gelombang TV dan Gelombang Radio.
· penggunaannya sebagian besar untuk pemancar radio dan TV
Manfaat Gelombang Elektromagnetik
 Sebelum mengetahui apa saja manfaat gelombang elektromagnetik, sebaiknya
kita patut tahu apa yang dimaksud gelombang elektromagnetik ??
Sebelum mengetahui apa saja manfaat gelombang elektromagnetik, sebaiknya
kita patut tahu apa yang dimaksud gelombang elektromagnetik ??Gelombang elektromagnetik yaitu rambatan perubahan (getaran) medan magnet dan medan listrik yang saling tegak lurus ke segala arah .
Gelombang elektromagnetik itu sendiri terbagi menjadi beberapa jenis gelombang :
1. Sinar Gamma ( industri, teknik, kedoteran, dll )
2. Sinar – X ( Diagnosa organ dalam tubuh )
3. Sinar ultraviolet ( Sterilisasi )
4. Sinar Tampak ( untuk membuat alat optik )
5. Inframerah ( Penelitian sruktur atom )
6. Radar ( menentukan jarak/sasaran )
7. Radio ( penyampaian pesan/informasi )
Dari ke-7 jenis gelombang tersebut saya akan memberi tahu sedikit tentang cara kerja radio saat menerima gelombang. pertama gelombang radio dari udara diterima melalui rangkaian penala. komponen utama dalam rangkaian ini adalah induktor. setelah di tala lalu masuk ke dalam rangkaian mixer. komponen utama mixer adalah transitor dan osilator.
Di sini getaran rendah dari udara di campurkan dengan getaran tinggi dari Osilator melalui Transistor sehingga level sinus getaran menjadi cukup kuat untuk dipisahkan. setelah dicampur lalu dideteksi oleh rangkaian detektor, yang komponennya terdiri atas diode. Rangkaian ini berfungsi untuk memisahkan antara gelombang suara dan gelombang pembawa (Career wave) sehingga gelombang pembawa tidak terbaca oleh rangkaian berikutnya. setelah dideteksi lalu diperkuat dengan penguat daya (Power Amplifier). setelah itu baru suaranya bisa anda nikmati dengan speaker yang berkualitas bagus .
Spektrum elektromagnetik
Spektrum elektromagnetik adalah rentang semua radiasi elektromagnetik yang mungkin. Spektrum elektromagnetik dapat dijelaskan dalam panjang gelombang, frekuensi, atau tenaga per foton. Spektrum ini secara langsung berkaitan (lihat juga tabel dan awalan SI):
- Panjang gelombang dikalikan dengan frekuensi, hasilnya kecepatan cahaya: 300 Mm/s, yaitu 300 MmHz
- Energi dari foton adalah 4.1 feV per Hz, yaitu 4.1μeV/GHz
- Panjang gelombang dikalikan dengan energi per foton adalah 1.24 μeVm

Referensi
1. ^ Léna, Pierre (1998). Observational Astrophysics. Springer-Verlag. ISBN 3-540-63482-7.wikipedia.org
Spektrofotometri Infra Merah

Spektrofotometri Infra Red atau Infra Merah merupakan suatu metode yang mengamati interaksi molekul dengan radiasi elektromagnetik yang berada pada daerah panjang gelombang 0,75 – 1.000 µm atau pada Bilangan Gelombang 13.000 – 10 cm-1. Radiasi elektromagnetik dikemukakan pertama kali oleh James Clark Maxwell, yang menyatakan bahwa cahaya secara fisis merupakan gelombang elektromagnetik, artinya mempunyai vektor listrik dan vektor magnetik yang keduanya saling tegak lurus dengan arah rambatan.
Gambaran berkas radiasi elektromagnetik diperlihatkan pada Gambar 1 berikut :
Saat ini telah dikenal berbagai macam gelombang elektromagnetik dengan rentang panjang gelombang tertentu. Spektrum elektromagnetik merupakan kumpulan spektrum dari berbagai panjang gelombang. Berdasarkan pembagian daerah panjang gelombang pada Tabel 1 dan Gambar 2, sinar infra merah dibagi atas tiga daerah, yaitu:
a. Daerah Infra Merah dekat.
b. Daerah Infra Merah pertengahan.
c. Daerah infra merah jauh..


Dari pembagian daerah spektrum elektromagnetik tersebut diatas, daerah panjang gelombang yang digunakan pada alat spektrofotometer infra merah adalah pada daerah infra merah pertengahan, yaitu pada panjang gelombang 2,5 – 50 µm atau pada bilangan gelombang 4.000 – 200 cm-1. Satuan yang sering digunakan dalam spektrofotometri infra merah adalah Bilangan Gelombang (
Interaksi Sinar Infra Merah Dengan Molekul
 Dasar
Spektroskopi Infra Merah dikemukakan oleh Hooke dan didasarkan atas
senyawa yang terdiri atas dua atom atau diatom yang digambarkan dengan
dua buah bola yang saling terikat oleh pegas seperti tampak pada gambar
disamping ini. Jika pegas direntangkan atau ditekan pada jarak
keseimbangan tersebut maka energi potensial dari sistim tersebut akan
naik.
Dasar
Spektroskopi Infra Merah dikemukakan oleh Hooke dan didasarkan atas
senyawa yang terdiri atas dua atom atau diatom yang digambarkan dengan
dua buah bola yang saling terikat oleh pegas seperti tampak pada gambar
disamping ini. Jika pegas direntangkan atau ditekan pada jarak
keseimbangan tersebut maka energi potensial dari sistim tersebut akan
naik.Setiap senyawa pada keadaan tertentu telah mempunyai tiga macam gerak, yaitu :
- Gerak Translasi, yaitu perpindahan dari satu titik ke titik lain.
- Gerak Rotasi, yaitu berputar pada porosnya, dan
- Gerak Vibrasi, yaitu bergetar pada tempatnya.
Panjang gelombang atau bilangan gelombang dan kecepatan cahaya dihubungkan dengan frekwensi melalui bersamaan berikut :

Energi yang timbul juga berbanding lurus dengan frekwesi dan digambarkan dengan persamaan Max Plank :

sehingga :

dimana :
E = Energi, Joule
h = Tetapan Plank ; 6,6262 x 10-34 J.s
c = Kecepatan cahaya ; 3,0 x 1010 cm/detik
n = indeks bias (dalam keadaan vakum harga n = 1)
l = panjang gelombang ; cm
u = frekwensi ; Hertz
Dalam spektroskopi infra merah panjang gelombang dan bilangan gelombang adalah nilai yang digunakan untuk menunjukkan posisi dalam spektrum serapan. Panjang gelombang biasanya diukur dalam mikron atau mikro meter ( µm ). Sedangkan bilangan gelombang (

Posisi pita serapan dapat diprediksi berdasarkan teori mekanikal tentang osilator harmoni, yaitu diturunkan dari hukum Hooke tentang pegas sederhana yang bergetar, yaitu :

dimana :

Keterangan :
c = kecepatan cahaya : 3,0 x 1010 cm/detik
k = tetapan gaya atau kuat ikat, dyne/cm
µ = massa tereduksi
m = massa atom, gram
Setiap molekul memiliki harga energi yang tertentu. Bila suatu senyawa menyerap energi dari sinar infra merah, maka tingkatan energi di dalam molekul itu akan tereksitasi ke tingkatan energi yang lebih tinggi. Sesuai dengan tingkatan energi yang diserap, maka yang akan terjadi pada molekul itu adalah perubahan energi vibrasi yang diikuti dengan perubahan energi rotasi.
Perubahan Energi Vibrasi
Atom-atom di dalam molekul tidak dalam keadaan diam, tetapi biasanya terjadi peristiwa vibrasi. Hal ini bergantung pada atom-atom dan kekuatan ikatan yang menghubungkannya. Vibrasi molekul sangat khas untuk suatu molekul tertentu dan biasanya disebut vibrasi finger print. Vibrasi molekul dapat digolongkan atas dua golongan besar, yaitu :
- Vibrasi Regangan (Streching)
- Vibrasi Bengkokan (Bending)
Dalam vibrasi ini atom bergerak terus sepanjang ikatan yang menghubungkannya sehingga akan terjadi perubahan jarak antara keduanya, walaupun sudut ikatan tidak berubah. Vibrasi regangan ada dua macam, yaitu:
- Regangan Simetri, unit struktur bergerak bersamaan dan searah dalam satu bidang datar.
- Regangan Asimetri, unit struktur bergerak bersamaan dan tidak searah tetapi masih dalam satu bidang datar.

Vibrasi Bengkokan (Bending)
Jika sistim tiga atom merupakan bagian dari sebuah molekul yang lebih besar, maka dapat menimbulkan vibrasi bengkokan atau vibrasi deformasi yang mempengaruhi osilasi atom atau molekul secara keseluruhan. Vibrasi bengkokan ini terbagi menjadi empat jenis, yaitu :
- Vibrasi Goyangan (Rocking), unit struktur bergerak mengayun asimetri tetapi masih dalam bidang datar.
- Vibrasi Guntingan (Scissoring), unit struktur bergerak mengayun simetri dan masih dalam bidang datar.
- Vibrasi Kibasan (Wagging), unit struktur bergerak mengibas keluar dari bidang datar.
- Vibrasi Pelintiran (Twisting), unit struktur berputar mengelilingi ikatan yang menghubungkan dengan molekul induk dan berada di dalam bidang datar.

Daerah Spektrum Infra Merah
Para ahli kimia telah memetakan ribuan spektrum infra merah dan menentukan panjang gelombang absorbsi masing-masing gugus fungsi. Vibrasi suatu gugus fungsi spesifik pada bilangan gelombang tertentu. Dari Tabel 2 diketahui bahwa vibrasi bengkokan C–H dari metilena dalam cincin siklo pentana berada pada daerah bilangan gelombang 1455 cm-1. Artinya jika suatu senyawa spektrum senyawa X menunjukkan pita absorbsi pada bilangan gelombang tersebut tersebut maka dapat disimpulkan bahwa senyawa X tersebut mengandung gugus siklo pentana.
Daerah Identifikasi
Vibrasi yang digunakan untuk identifikasi adalah vibrasi bengkokan, khususnya goyangan (rocking), yaitu yang berada di daerah bilangan gelombang 2000 – 400 cm-1. Karena di daerah antara 4000 – 2000 cm-1 merupakan daerah yang khusus yang berguna untuk identifkasi gugus fungsional. Daerah ini menunjukkan absorbsi yang disebabkan oleh vibrasi regangan. Sedangkan daerah antara 2000 – 400 cm-1 seringkali sangat rumit, karena vibrasi regangan maupun bengkokan mengakibatkan absorbsi pada daerah tersebut.
Dalam daerah 2000 – 400 cm-1 tiap senyawa organik mempunyai absorbsi yang unik, sehingga daerah tersebut sering juga disebut sebagai daerah sidik jari (fingerprint region). Meskipun pada daerah 4000 – 2000 cm-1 menunjukkan absorbsi yang sama, pada daerah 2000 – 400 cm-1 juga harus menunjukkan pola yang sama sehingga dapat disimpulkan bahwa dua senyawa adalah sama.
Daerah Identifikasi
Vibrasi yang digunakan untuk identifikasi adalah vibrasi bengkokan, khususnya goyangan (rocking), yaitu yang berada di daerah bilangan gelombang 2000 – 400 cm-1. Karena di daerah antara 4000 – 2000 cm-1 merupakan daerah yang khusus yang berguna untuk identifkasi gugus fungsional. Daerah ini menunjukkan absorbsi yang disebabkan oleh vibrasi regangan. Sedangkan daerah antara 2000 – 400 cm-1 seringkali sangat rumit, karena vibrasi regangan maupun bengkokan mengakibatkan absorbsi pada daerah tersebut.
Dalam daerah 2000 – 400 cm-1 tiap senyawa organik mempunyai absorbsi yang unik, sehingga daerah tersebut sering juga disebut sebagai daerah sidik jari (fingerprint region). Meskipun pada daerah 4000 – 2000 cm-1 menunjukkan absorbsi yang sama, pada daerah 2000 – 400 cm-1 juga harus menunjukkan pola yang sama sehingga dapat disimpulkan bahwa dua senyawa adalah sama.
Perkembangan Teori Atom
1. Perkembangan Teori Atom
Perkembangan teori atom telah dimulai sejak sebelum masehi oleh ahli-ahli filsafat Yunani. Demokritos (460 – 370 SM), seorang filsuf Yunani mengemukakan istilah atom dalam bahasa Yunani sebagai atomos yang berarti tidak dapat dibagi-bagi lagi. Dari kata itulah, Demokritos mendefinisikan atom sebagai partikel yang tidak dapat dibagi-bagi lagi. Namun konsep atom ini, hanyalah merupakan pemikiran semata tanpa dibuktikan dengan hasil eksperimen.
Meskipun pemikiran tersebut benar, tetapi memiliki kelemahan, yakni tidak dapat menjawab pertanyaan tentang hakekat dan sifat atom itu sendiri.
2. Teori Atom Dalton
John Dalton (1766 – 1844), adalah seorang ilmuwan Inggris. Berdasarkan percobaan-percobaan dan penelitian yang dilakukannya, ia membuat teori atom sebagai berikut:
Namun, seiring dengan kemajuan ilmu pengetahuan dan teknologi, khususnya penemuan-penemuan dalam bidang listrik, maka teori atom Dalton yang menyatakan atom merupakan partikel terkecil yang tak dapat dibagi lagi mulai diragukan oleh banyak ilmuwan.
3. Model Atom Thomson
Setelah elektron ditemukan sebagai partikel hasil peruraian atom, menjadikan teori atom Dalton tak berlaku lagi. Dengan penemuan elektron ini, maka atom bukan lagi suatu partikel terkecil yang tidak dapat dibagi lagi. Penemuan elektron pertama kali dijelaskan oleh Michael Faraday yang beranggapan bahwa partikel-partikel elektron bersifat sebagai pembawa arus listrik negatif. Beberapa ilmuwan lain, seperti: Goldstein, Crookes, Lenard, Perrin, Hertz dan J.J Thomson juga menegaskan akan adanya elektron sebagai partikel hasil peruraian atom.
Pada tahun 1904, J. J Thomson mengemukakan suatu model atom yang berbeda dengan teori atom Dalton. Menurut Thomson, atom merupakan bola padat dan mempunyai muatan positif yang terbagi rata ke seluruh atom. Muatan ini dinetralkan oleh elektron-elektron yang juga tersebar mengelilingi atom. Model atom Thomson disebut juga sebagai model puddding Thomson atau model roti kismis. Coba Anda perhatikan model atom Thomson pada gambar di bawah ini.
Model atom Thomson memiliki kelemahan yaitu belum ada bagian-bagian atom atau dengan kata lain tidak ada pemisahan antara elektron dan proton, karena kedua tersebar merata ke seluruh atom.
Sekarang, marilah Anda pelajari model atom berikutnya, yaitu model atom Rutherford.
4. Model Atom Rutherford
Untuk beberapa ilmuwan, seperti Lenard dan Rutherford, model atom Thomson masih perlu dibuktikan kebenarannya melalui percobaan secara empiris.
Ernest Rutherford (1871 – 1937), seorang ilmuwan Inggris bersama dua orang asistennya Geiger dan Marsden pada tahun 1911, menguji kebenaran model atom Thomson. Mereka melakukan percobaan dengan menembakkan sinar alfa (α) melalui celah pelat timbal dan ditumbukkan dengan lempeng emas tipis yang berukuran 0,01 mm. Untuk mendeteksi partikel alfa yang keluar dari lempeng emas, dipasang layar yang berlapis seng sulfida. Apabila partikel α bertumbukkan dengan lempeng ini maka akan menyebabkan nyala sekilas atau fluoresensi yang dapat terlihat secara jelas. Untuk lebih jelasnya, Anda perhatikan bagan percobaan Rutherford pada gambar di bawah ini.
Hasil pengamatan Rutherford dinyatakan sebagai berikut:
- Sebagian besar sinar α dapat menembus lempeng emas dengan lurus, hal ini terjadi karena tidak dipengaruhi oleh elektron-elektron. Karena sebagian besar bagian atom merupakan ruang kosong.
- Sebagian kecil sinar α dibelokkan, karena lintasannya terlalu dekat dengan inti atom, sehingga dipengaruhi oleh gaya tolak inti atom. Karena inti atom bermuatan positif.
- Sedikit sekali sinar α dipantulkan kembali sebab tepat bertumbukkan dengan inti atom. Karena massa atom terpusatkan pada inti atom.
Hasil percobaan Rutherford ini dapat digambarkan seperti pada gambar 1.4 di bawah.
Dengan kenyataan seperti itu, Rutherford membuat teori atom, sebagai berikut:
Ada dua kelemahan pada model atom Rutherford. Kelemahan pertama, yaitu: elektron yang bermuatan negatif bergerak mengelilingi inti atom yang bermuatan positif sambil mendapatkan percepatan ke arah inti atom karena pengaruh gaya tarik inti atom. Berdasarkan hukum-hukum elektromagnetik, gerakan elektron yang demikian akan menimbulkan gelombang elektromagnetik dan memancarkan energi. Akibatnya energi elektron akan menyusut, sehingga jari-jari lintasannya akan mengecil.
Maka lintasan elektron tidak lagi merupakan lingkaran berjari-jari sama, namun merupakan spiral atau putaran yang berpilin mendekati inti atom, hingga akhirnya elektron jatuh ke inti atom, seperti pada gambar 1.6 di bawah. Tetapi kenyataannya hal ini tidak pernah terjadi. Setiap elektron yang bergerak mengitari inti atom tidak pernah mendekati dan masuk bergabung dengan inti atom. Dari penjelasan di atas, dapat Anda simpulkan bahwa model atom Rutherford tidak dapat menjelaskan konsep kestabilan atom.
Kelemahan kedua, model atom Rutherford tidak dapat menjelaskan spektrum garis hidrogen. Hal ini terjadi karena lintasan elektron semakin mengecil, sehingga waktu putarnya juga berkurang dan frekuensi gelombang yang dipancarkan menjadi beraneka ragam. Sehingga, atom hidrogen tidak akan menunjukkan spektrum garis tertentu, namun spektrumnya merupakan spektrum kontinu. Sedangkan pada kenyataannya dengan menggunakan spektrometer menunjukkan bahwa spektrum atom hidrogen merupakan garis yang khas.
Tidak sulit, bukan? Apabila belum paham, pelajari kembali materi tersebut baik-baik. Bagi Anda yang sudah paham, Anda dapat melanjutkan ke materi berikut ini.
5. Model Atom Bohr
Pada tahun 1913 berdasarkan hasil suatu penelitian, Neils Bohr (1885 – 1962), seorang ilmuwan Swedia memperbaiki dua kelemahan model atom Rutherford. Bohr menyusun model atom hidrogen berdasarkan model atom Rutherford dan teori kuantum Planck.
Bohr mengemukakan dua postulat tentang model atomnya, postulat pertama menyatakan: Elektron tidak dapat bergerak mengelilingi inti melalui sembarang lintasan, namun elektron hanya dapat berputar di sekitar inti melalui lintasan tertentu tanpa melepaskan energi. Dimana lintasan tersebut dinamakan lintasan stasioner.
Pada lintasan stasioner itu elektron mempunyai momentum anguler. Meskipun postulat ini bertentangan dengan teori elektromagnetik, namun hal ini benar dan dapat dibuktikan dengan teori kuantum Planck atau mekanika kuantum.
Dari postulat pertama Bohr, jelas bahwa lintasan elektron adalah tetap dan merupakan deret tertentu.
Kulit paling dekat ke inti yang merupakan lintasan elektron terdalam (terkecil) mempunyai tingkat energi terendah dinamakan kulit K, selanjutnya kulit lebih luar dengan energi yang lebih tinggi disebut kulit L, kemudian kulit M, N dan seterusnya.
Sedangkan postulat kedua Bohr menyatakan: Elektron dapat berpindah lintasan dari lintasan luar ke lintasan dalam sambil membebaskan atau memancarkan energi foton (cahaya) sebesar hf, bila berpindah lintasan dari lintasan dalam ke lintasan luar akan menyerap energi foton juga sebesar hf. Dengan kata lain dapat pula dinyatakan: Elektron pindah dari lintasan dengan bilangan kuantum utama besar ke lintasan dengan bilangan kuantum kecil, elektron memancarkan energi foton (cahaya), jika sebaliknya elektron menyerap energi foton.
Secara skematis proses perpindahan elektron dari lintasan luar ke lintasan dalam sambil membebaskan atau memancarkan energi sebesar hf, dan perpindahan elektron dari lintasan dalam ke lintasan luar sambil menyerap energi.
Dari teori atom Bohr yang telah Anda pelajari di atas, jelaslah kini bahwa model atom Bohr merupakan penyempurnaan dari model atom Rutherford, sehingga model atom ini dinamakan juga sebagai model atom Rutherford – Bohr, yang berbunyi:
Perkembangan teori atom telah dimulai sejak sebelum masehi oleh ahli-ahli filsafat Yunani. Demokritos (460 – 370 SM), seorang filsuf Yunani mengemukakan istilah atom dalam bahasa Yunani sebagai atomos yang berarti tidak dapat dibagi-bagi lagi. Dari kata itulah, Demokritos mendefinisikan atom sebagai partikel yang tidak dapat dibagi-bagi lagi. Namun konsep atom ini, hanyalah merupakan pemikiran semata tanpa dibuktikan dengan hasil eksperimen.
Meskipun pemikiran tersebut benar, tetapi memiliki kelemahan, yakni tidak dapat menjawab pertanyaan tentang hakekat dan sifat atom itu sendiri.
2. Teori Atom Dalton
John Dalton (1766 – 1844), adalah seorang ilmuwan Inggris. Berdasarkan percobaan-percobaan dan penelitian yang dilakukannya, ia membuat teori atom sebagai berikut:
- Atom merupakan partikel terkecil yang tak dapat dibagi lagi.
- Atom-atom suatu unsur semuanya sama dan tidak dapat berubah menjadi atom unsur lain.
- Dua atom atau lebih dari unsur-unsur yang berlainan dapat membentuk suatu molekul.
- Pada suatu reaksi kimia, atom-atom berpisah. Tetapi, kemudian dapat bergabung lagi dengan susunan berbeda dari semula menurut perbandingan tertentu, dengan massa keseluruhannya tetap.
- Pada reaksi kimia atom-atom bergabung menurut perbandingan tertentu yang sederhana.
Namun, seiring dengan kemajuan ilmu pengetahuan dan teknologi, khususnya penemuan-penemuan dalam bidang listrik, maka teori atom Dalton yang menyatakan atom merupakan partikel terkecil yang tak dapat dibagi lagi mulai diragukan oleh banyak ilmuwan.
3. Model Atom Thomson
Setelah elektron ditemukan sebagai partikel hasil peruraian atom, menjadikan teori atom Dalton tak berlaku lagi. Dengan penemuan elektron ini, maka atom bukan lagi suatu partikel terkecil yang tidak dapat dibagi lagi. Penemuan elektron pertama kali dijelaskan oleh Michael Faraday yang beranggapan bahwa partikel-partikel elektron bersifat sebagai pembawa arus listrik negatif. Beberapa ilmuwan lain, seperti: Goldstein, Crookes, Lenard, Perrin, Hertz dan J.J Thomson juga menegaskan akan adanya elektron sebagai partikel hasil peruraian atom.
Pada tahun 1904, J. J Thomson mengemukakan suatu model atom yang berbeda dengan teori atom Dalton. Menurut Thomson, atom merupakan bola padat dan mempunyai muatan positif yang terbagi rata ke seluruh atom. Muatan ini dinetralkan oleh elektron-elektron yang juga tersebar mengelilingi atom. Model atom Thomson disebut juga sebagai model puddding Thomson atau model roti kismis. Coba Anda perhatikan model atom Thomson pada gambar di bawah ini.
Model atom Thomson memiliki kelemahan yaitu belum ada bagian-bagian atom atau dengan kata lain tidak ada pemisahan antara elektron dan proton, karena kedua tersebar merata ke seluruh atom.
Sekarang, marilah Anda pelajari model atom berikutnya, yaitu model atom Rutherford.
4. Model Atom Rutherford
Untuk beberapa ilmuwan, seperti Lenard dan Rutherford, model atom Thomson masih perlu dibuktikan kebenarannya melalui percobaan secara empiris.
Ernest Rutherford (1871 – 1937), seorang ilmuwan Inggris bersama dua orang asistennya Geiger dan Marsden pada tahun 1911, menguji kebenaran model atom Thomson. Mereka melakukan percobaan dengan menembakkan sinar alfa (α) melalui celah pelat timbal dan ditumbukkan dengan lempeng emas tipis yang berukuran 0,01 mm. Untuk mendeteksi partikel alfa yang keluar dari lempeng emas, dipasang layar yang berlapis seng sulfida. Apabila partikel α bertumbukkan dengan lempeng ini maka akan menyebabkan nyala sekilas atau fluoresensi yang dapat terlihat secara jelas. Untuk lebih jelasnya, Anda perhatikan bagan percobaan Rutherford pada gambar di bawah ini.
Hasil pengamatan Rutherford dinyatakan sebagai berikut:
- Sebagian besar sinar α dapat menembus lempeng emas dengan lurus, hal ini terjadi karena tidak dipengaruhi oleh elektron-elektron. Karena sebagian besar bagian atom merupakan ruang kosong.
- Sebagian kecil sinar α dibelokkan, karena lintasannya terlalu dekat dengan inti atom, sehingga dipengaruhi oleh gaya tolak inti atom. Karena inti atom bermuatan positif.
- Sedikit sekali sinar α dipantulkan kembali sebab tepat bertumbukkan dengan inti atom. Karena massa atom terpusatkan pada inti atom.
Hasil percobaan Rutherford ini dapat digambarkan seperti pada gambar 1.4 di bawah.
Dengan kenyataan seperti itu, Rutherford membuat teori atom, sebagai berikut:
- Muatan positif berkumpul pada suatu titik di tengah-tengah atom yang disebut inti atom.
- Muatan negatif (elektron) berada di luar inti atom dan bergerak mengelilingi inti pada lintasannya seperti planet-planet mengelilingi matahari pada sistem tata surya.
Ada dua kelemahan pada model atom Rutherford. Kelemahan pertama, yaitu: elektron yang bermuatan negatif bergerak mengelilingi inti atom yang bermuatan positif sambil mendapatkan percepatan ke arah inti atom karena pengaruh gaya tarik inti atom. Berdasarkan hukum-hukum elektromagnetik, gerakan elektron yang demikian akan menimbulkan gelombang elektromagnetik dan memancarkan energi. Akibatnya energi elektron akan menyusut, sehingga jari-jari lintasannya akan mengecil.
Maka lintasan elektron tidak lagi merupakan lingkaran berjari-jari sama, namun merupakan spiral atau putaran yang berpilin mendekati inti atom, hingga akhirnya elektron jatuh ke inti atom, seperti pada gambar 1.6 di bawah. Tetapi kenyataannya hal ini tidak pernah terjadi. Setiap elektron yang bergerak mengitari inti atom tidak pernah mendekati dan masuk bergabung dengan inti atom. Dari penjelasan di atas, dapat Anda simpulkan bahwa model atom Rutherford tidak dapat menjelaskan konsep kestabilan atom.
Kelemahan kedua, model atom Rutherford tidak dapat menjelaskan spektrum garis hidrogen. Hal ini terjadi karena lintasan elektron semakin mengecil, sehingga waktu putarnya juga berkurang dan frekuensi gelombang yang dipancarkan menjadi beraneka ragam. Sehingga, atom hidrogen tidak akan menunjukkan spektrum garis tertentu, namun spektrumnya merupakan spektrum kontinu. Sedangkan pada kenyataannya dengan menggunakan spektrometer menunjukkan bahwa spektrum atom hidrogen merupakan garis yang khas.
Tidak sulit, bukan? Apabila belum paham, pelajari kembali materi tersebut baik-baik. Bagi Anda yang sudah paham, Anda dapat melanjutkan ke materi berikut ini.
5. Model Atom Bohr
Pada tahun 1913 berdasarkan hasil suatu penelitian, Neils Bohr (1885 – 1962), seorang ilmuwan Swedia memperbaiki dua kelemahan model atom Rutherford. Bohr menyusun model atom hidrogen berdasarkan model atom Rutherford dan teori kuantum Planck.
Bohr mengemukakan dua postulat tentang model atomnya, postulat pertama menyatakan: Elektron tidak dapat bergerak mengelilingi inti melalui sembarang lintasan, namun elektron hanya dapat berputar di sekitar inti melalui lintasan tertentu tanpa melepaskan energi. Dimana lintasan tersebut dinamakan lintasan stasioner.
Pada lintasan stasioner itu elektron mempunyai momentum anguler. Meskipun postulat ini bertentangan dengan teori elektromagnetik, namun hal ini benar dan dapat dibuktikan dengan teori kuantum Planck atau mekanika kuantum.
Dari postulat pertama Bohr, jelas bahwa lintasan elektron adalah tetap dan merupakan deret tertentu.
Kulit paling dekat ke inti yang merupakan lintasan elektron terdalam (terkecil) mempunyai tingkat energi terendah dinamakan kulit K, selanjutnya kulit lebih luar dengan energi yang lebih tinggi disebut kulit L, kemudian kulit M, N dan seterusnya.
Sedangkan postulat kedua Bohr menyatakan: Elektron dapat berpindah lintasan dari lintasan luar ke lintasan dalam sambil membebaskan atau memancarkan energi foton (cahaya) sebesar hf, bila berpindah lintasan dari lintasan dalam ke lintasan luar akan menyerap energi foton juga sebesar hf. Dengan kata lain dapat pula dinyatakan: Elektron pindah dari lintasan dengan bilangan kuantum utama besar ke lintasan dengan bilangan kuantum kecil, elektron memancarkan energi foton (cahaya), jika sebaliknya elektron menyerap energi foton.
Secara skematis proses perpindahan elektron dari lintasan luar ke lintasan dalam sambil membebaskan atau memancarkan energi sebesar hf, dan perpindahan elektron dari lintasan dalam ke lintasan luar sambil menyerap energi.
Dari teori atom Bohr yang telah Anda pelajari di atas, jelaslah kini bahwa model atom Bohr merupakan penyempurnaan dari model atom Rutherford, sehingga model atom ini dinamakan juga sebagai model atom Rutherford – Bohr, yang berbunyi:
- Atom terdiri dari inti atom yang bermuatan positif, terletak di pusat inti dan elektron yang berputar mengelilingi inti atom pada lintasan-lintasan tertentu.
- Elektron hanya bisa berada pada lintasan tertentu dan bisa berpindah dari lintasan yang satu ke lintasan yang lainnya, namun tidak dapat menempati sembarang lintasan.
- Model atom Bohr hanya berlaku untuk atom hidrogen, sedangkan untuk atom lain memiliki perhitungan yang berbeda.
- Lintasan elektron yang mengelilingi inti bukan merupakan lingkaran saja, namun bermacam-macam bentuk lingkaran, sehingga amat rumit.
- Bohr tidak dapat menjelaskan peristiwa-peristiwa atom dalam suatu ikatan kimia dan pengaruhnya terhadap medan magnet.
Minggu, 11 Maret 2012
Gravitasi dan Hukum Keppler
Gravitasi
Gravitasi adalah gaya tarik-menarik yang terjadi antara semua partikel yang mempunyai massa di alam semesta. Fisika modern mendeskripsikan gravitasi menggunakan Teori Relativitas Umum dari Einstein, namun hukum gravitasi universal Newton yang lebih sederhana merupakan hampiran yang cukup akurat dalam kebanyakan kasus.
 Sebagai contoh, bumi
yang memiliki massa yang sangat besar menghasilkan gaya gravitasi yang
sangat besar untuk menarik benda-benda di sekitarnya, termasuk makhluk hidup, dan benda-benda yang ada di bumi. Gaya gravitasi ini juga menarik benda-benda yang ada di luar angkasa, seperti bulan, meteor, dan benda angkasa lainnya, termasuk satelit buatan manusia.
Sebagai contoh, bumi
yang memiliki massa yang sangat besar menghasilkan gaya gravitasi yang
sangat besar untuk menarik benda-benda di sekitarnya, termasuk makhluk hidup, dan benda-benda yang ada di bumi. Gaya gravitasi ini juga menarik benda-benda yang ada di luar angkasa, seperti bulan, meteor, dan benda angkasa lainnya, termasuk satelit buatan manusia.
Hukum gravitasi universal Newton dirumuskan sebagai berikut:
Setiap
massa titik menarik semua massa titik lainnya dengan gaya segaris
dengan garis yang menghubungkan kedua titik. Besar gaya tersebut
berbanding lurus dengan perkalian kedua massa tersebut dan berbanding
terbalik dengan kuadrat jarak antara kedua massa titik tersebut.
Keterangan :
F adalah besar dari gaya gravitasi antara kedua massa titik tersebut (N)
m1 adalah besar massa titik pertama (kg)
m2 adalah besar massa titik kedua (kg)
r adalah jarak antara kedua massa titik (m)
g adalah percepatan gravitasi (m/s2)
Catatan:
· F12
adalah gaya gravitasi yang dialami oleh benda m1 yang dikerjakan oleh
m2. F12 merupakan gaya aksi dan F21 adalah gaya reaksi, jadi F12 adalah
gaya yang gravitasi yang bekerja pada benda berbeda, mempunyai besar
yang sama dan berlawanan arah
· Benda
dianggap berbentuk bola homogen atau berupa titik materi sehingga r
yang digunakan adalah jarak pisah antarkedua benda atau jarak antara
pusat suatu benda dengan pusat benda lain
· Garis kerja gaya gravitasi terletak pada garis hubung yang menghubungkan pusat benda pertama dengan kedua
· Tetapan gravitasi G, ditentukan secara eksperimen oleh banyak ahli, dimulai pada tahun 1798 oleh Henry Cavendish
Percepatan Gravitasi
Percepatan gravitasi di permukaan bumi secara rata-rata dikatakan ekivalen dengan 1 g
yang didefinisikan bernilai 9,8 m/s2. Kenyataannya, nilai gravitasi
(g) sedikit berubah dari satu titik ke titik lain di permukaan bumi,
dari kira-kira 9, 78 m/s2 sampai 9,82 m/s2.
Beberapa faktor yang mempengaruhi hal tersebut antara lain:
· Bumi kita tidak benar-benar bulat, percepatan gravitasi bergantung pada jaraknya dari pusat bumi (planet)
· Percepatan gravitasi tergantung dari jaraknya terhadap permukaan bumi. Semakin tinggi sebuah benda dari permukaan bumi, semakin kecil percepatan gravitasi
· Percepatan gravitasi bergantung pada planet tempat benda berada, di mana setiap planet, satelit atau benda angkasa lainnya memiliki gravitasi yang berbeda
Nilai g
dapat diukur dengan berbagai metoda. Bentuk-bentuk paling sederhana
misalnya dengan menggunakan pegas atau bandul yang diketahui
konstanta-konstantanya. Dengan
melakukan pengukuran dapat ditentukan nilai percepatan gravitasi di
suatu tempat, yang umumnya berbeda dengan tempat lain.
Dalam bidang fisika bumi dikenal pula metoda gravitasi
yaitu suatu metoda pengukuran perbedaan percepatan gravitasi suatu
tempat untuk memperkirakan kandungan tanah yang berada di bawah titik
pengukuran. Dengan cara ini dapat diduga (bersama-sama dengan
pemanfaatan metoda fisika bumi lainnya) struktur dan juga unsur-unsur
pembentuk lapisan tanah yang tersusun atas elemen yang memiliki rapat
massa yang berbeda-beda.
Kuat Medan Gravitasi
Gaya
gravitasi merupakan gaya interaksi antara dua benda atau lebih tetapi
benda-benda tersebut tidak saling bersentuhan. Hal ini dikarenakan
adanya suatu medan gravitasi yang bekerja pada benda tersebut.
Medan dapat didefinisikan sebagai
daerah pengaruh dari suatu besaran fisis yang mengerjakan gaya pada
entitas yang sesuai bila entitas itu berada dalam daerah itu, dalam hal ini entitas untuk gaya gravitasi adalah massa.
Sedangkan medan gravitasi didefinisikan sebagai ruang di sekitar suatu benda bermassa m di mana benda bermassa lainnya dalam ruang itu akan mengalami gaya gravitasi.
Medan
gravitasi sering digambarkan dengan garis-garis medan gravitasi yang
merupakan garis bersambungan yang selalu berarah menuju ke massa sumber
medan gravitasi itu, sehingga jika garis-garis medan gravitasi itu rapat
menunjukkan makin besar medan gravitasinya.
Besaran yang mewakili medan gravitasi adalah kuat medan gravitasi (g) yang didefinisikan sebagai gaya gravitasi per satuan massa pada suatu massa uji M. Kuat medan gravitasi ini disebut juga dengan percepatan gravitasi.
Misalkan gaya gravitasi yang dikerjakan oleh benda bermassa M pada benda bermassa m besarnya adalah:
Dari definisi kuat medan gravitasi (g) didapatkan:
Seperti
halnya gaya gravitasi, kuat medan gravitasi suatu benda juga dapat
dipengaruhi oleh beberapa benda bermassa M sekaligus, dan perhitungannya
juga sama yaitu dengan menggunakan kaidah besaran vektor.
Perbandingan
percepatan gravitasi di suatu titik di atas permukaan bumi yang
berjarak h (misalkan titik B) dengan percepatan gravitasi di permukaan
bumi (misalkan titik A) dapat dihitung dengan :
Oleh karena rB = rA + h (dimana r = jari-jari bumi) maka:
Hukum Kepler
Di dalam astronomi, tiga Hukum Gerakan Planet Kepler adalah:
1. Setiap planet bergerak dengan lintasan elips, matahari berada di salah satu fokusnya.
Kepler
tidak mengetahui alasan mengapa planet bergerak dengan cara demikian.
Ketika mulai tertarik dengan gerak planet-planet, Newton menemukan bahwa
ternyata hukum-hukum Kepler ini bisa diturunkan secara matematis dari
hukum gravitasi universal dan hukum gerak Newton. Newton juga
menunjukkan bahwa di antara kemungkinan yang masuk akal mengenai hukum
gravitasi, hanya satu yang berbanding terbalik dengan kuadrat jarak yang
konsisten dengan Hukum Kepler.
Perhatikan
orbit elips yang dijelaskan pada Hukum I Kepler. Dimensi paling panjang
pada orbit elips disebut sumbu mayor alias sumbu utama, dengan setengah
panjang a. Setengah panjang ini disebut sumbu semiutama alias semimayor.
F1 dan F2 adalah titik Fokus. Matahari berada pada F1 dan planet berada pada P. Tidak ada benda langit lainnya pada F2. Total jarak dari F1 ke P dan F2 ke P sama untuk semua titik dalam kurva elips. Jarak pusat elips (O) dan titik fokus (F1 dan F2) adalah ea, di mana e merupakan angka tak berdimensi yang besarnya berkisar antara 0 sampai 1, disebut juga eksentrisitas. Jika e = 0 maka elips berubah menjadi lingkaran. Kenyataanya, orbit planet berbentuk elips alias mendekati lingkaran. Dengan demikian besar eksentrisitas tidak pernah bernilai nol. Nilai e untuk orbit planet bumi adalah 0,017. Perihelion merupakan titik yang terdekat dengan matahari, sedangkan titik terjauh adalah aphelion.
Pada
Persamaan Hukum Gravitasi Newton, telah kita pelajari bahwa gaya tarik
gravitasi berbanding terbalik dengan kuadrat jarak (1/r2), di mana hal ini hanya bisa terjadi pada orbit yang berbentuk elips atau lingkaran saja.
2. Luas daerah yang disapu pada selang waktu yang sama akan selalu sama.
Secara matematis:
dimana
adalah "areal velocity".
Bahwa
Planet bergerak lebih cepat di dekat matahari dan lambat di jarak yang
jauh. Sehingga, jumlah area adalah sama pada jangka waktu tertentu.
Lebih jelasnya :
Hal
yang paling utama dalam Hukum II Kepler adalah kecepatan sektor
mempunyai harga yang sama pada semua titik sepanjang orbit yang
berbentuk elips.
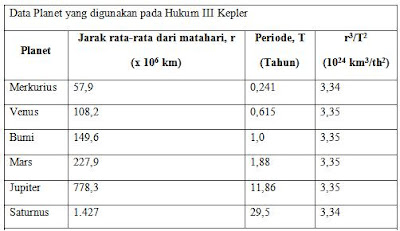
Jika T1 dan T2 menyatakan periode dua planet, dan r1 dan r2 menyatakan jarak rata-rata mereka dari matahari, maka
Newton
menunjukkan bahwa Hukum III Kepler juga bisa diturunkan secara
matematis dari Hukum Gravitasi Universal dan Hukum Newton tentang gerak
dan gerak melingkar. Sekarang mari kita tinjau Hukum III Kepler menggunakan pendekatan Newton.
Terlebih dahulu kita tinjau kasus khusus orbit lingkaran, yang merupakan kasus khusus dari orbit elips.
Sekarang kita masukan persamaan Hukum Gravitasi Newton dan percepatan sentripetal ke dalam persamaan Hukum II Newton :
m1 adalah massa planet, mM adalah massa matahari, r1 adalah jarak rata-rata planet dari matahari, v1 merupakan laju rata-rata planet pada orbitnya.
Waktu yang diperlukan sebuah planet untuk menyelesaikan satu orbit adalah T1, di mana jarak tempuhnya sama dengan keliling lingkaran, 2 phi r1. Dengan demikian, besar v1 adalah :
Misalnya
persamaan 1 kita turunkan untuk planet venus (planet 1). Penurunan
persamaan yang sama dapat digunakan untuk planet bumi (planet kedua).
T2 dan r2
adalah periode dan jari-jari orbit planet kedua. Sekarang coba anda
perhatikan persamaan 1 dan persamaan 2. Perhatikan bahwa ruas kanan
kedua persamaan memiliki nilai yang sama. Dengan demikian, jika kedua
persamaan ini digabungkan, akan kita peroleh :
Ketiga hukum diatas ditemukan oleh ahli matematika dan astronomi Jerman: Johannes Kepler (1571–1630), yang menjelaskan gerakan planet di dalam tata surya. Hukum di atas menjabarkan gerakan dua benda yang saling mengorbit.
Karya Kepler didasari oleh data observasi Tycho Brahe,
yang diterbitkannya sebagai 'Rudolphine tables'. Sekitar tahun 1605,
Kepler menyimpulkan bahwa data posisi planet hasil observasi Brahe
mengikuti rumusan matematika cukup sederhana yang tercantum di atas.
Hukum Kepler mempertanyakan kebenaran astronomi dan fisika warisan zaman Aristoteles dan Ptolemaeus.
Ungkapan Kepler bahwa Bumi beredar sekeliling, berbentuk elips dan
bukannya epicycle, dan membuktikan bahwa kecepatan gerak planet
bervariasi, merubah astronomi dan fisika. Hampir seabad kemudian, Isaac Newton
mendeduksi Hukum Kepler dari rumusan hukum karyanya, hukum gerak dan
hukum gravitasi Newton, dengan menggunakan Euclidean geometri klasik.
Pada
era modern, hukum Kepler digunakan untuk aproksimasi orbit satelit dan
benda-benda yang mengorbit matahari, yang semuanya belum ditemukan pada
saat Kepler hidup (contoh: planet luar dan asteroid). Hukum ini kemudian
diaplikasikan untuk semua benda kecil yang mengorbit benda lain yang
jauh lebih besar, walaupun beberapa aspek seperti gesekan atmosfer
(contoh: gerakan di orbit rendah), atau relativitas (contoh: prosesi
preihelion merkurius), dan keberadaan benda lainnya dapat membuat hasil
hitungan tidak akurat dalam berbagai keperluan.
Langganan:
Postingan (Atom)